水素化合物(すいそかごうぶつ、ハイドライド、英: Hydride)とは、水素と化合した物質のことである。特に、狭義には水素と他の元素とから構成される二元化合物が水素化物と呼ばれる。また、二元化合物以外の水素化合物も含めて水素化物と呼ぶ場合も多い。
また化学反応で水素と化合することを水素化という。
水素化物の分類
出典:
水素化物は分子状化合物、塩類似水素化物(saline hydride)および金属類似水素化物(metallic hydride)またはその中間の水素化物に分類される。アルカリ金属とアルカリ土類金属の水素化物は塩類似水素化物である。遷移金属元素ではSc、Ti、V、Cr、Y、Zr、Nb、Pd、Lu、Hf、Taの各水素化物が金属類似水素化物であることが分かっている。第13族から第17族元素の水素化物はAl、Bi、Poを抜いて分子状化合物である。また、Be、Mg、Al、Cu、Znはどちらでもない中間的な化合物である。
分子状水素化物
分子状水素化物は共有結合性水素化物とも呼ばれる。分子状水素化物の中には、水素原子がほぼ電気的中性であるものもあれば、陽性・陰性に傾いているものもある。
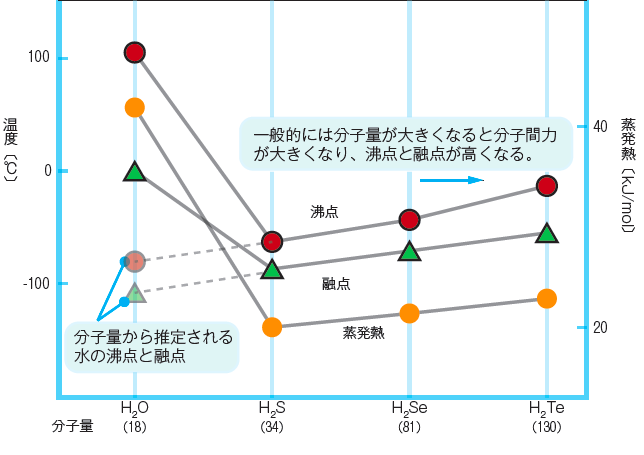
水素原子がほぼ電気的中性の場合、その水素化物分子にはたらく分子間力はファンデルワールス力のみとなるため、低沸点の化合物となる。たとえば、ホスフィン()の沸点は-90℃であり、この特徴を持つ水素化物である。
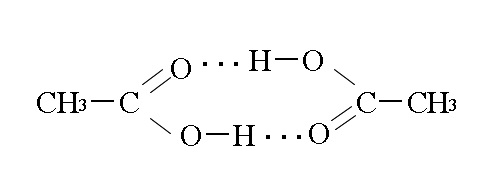
水素原子が正電荷を帯びた水素化物の場合には、それゆえ生じた双極子に起因する分子間力(プロトン性架橋)が生じるため、高い沸点と融点をもつ。
水素原子が陰性に傾いたヒドリド性水素は反応性が高く、このような特徴をもつジボラン()などは酸素と激しく反応する。
塩類似水素化物
塩類似水素化物はイオン性水素化物とも呼ばれる。反応性の高い白色固体であり、金属陽イオンと水素化物イオン(H-)から成る。これは、たとえば水素化リチウムの電気分解(溶融塩化リチウム中)において、陽極から水素が発生する反応が起こる ことからわかる。
金属類似水素化物
特定の遷移金属は金属類似水素化物を形成する。たとえば、水素化チタンの組成はとなっていると考えられており、これらの化合物が金属光沢や高い電気伝導性を示すのは、こうした自由電子による効果であると考えることができる。
金属類似水素化物は、高圧下で金属と水素を加熱することによって合成できるものが多い。
金属類似水素化物の中には、水素を効率的に貯蔵し、加熱することによって再度水素ガスとして取り出せるような性質を持つものがあり(水素吸蔵合金)、水素自動車への応用が期待されている。
典型元素の水素化物
おもな元素水素化物を示す。
出典: IUPAC Nomenclature of Organic Chemistry / Recommendations 1979 and Recommendations 1993 by ACD Lab. Inc. 他
金属の水素化物
主な金属の水素化物を示す。
- リチウム:水素化リチウム((LiH)
- ベリリウム:水素化ベリリウム(BeH2)
- ナトリウム:水素化ナトリウム(NaH)
- マグネシウム:水素化マグネシウム(MgH2)
- カリウム:水素化カリウム (KH)
- カルシウム:水素化カルシウム(CaH2)
- ルビジウム:水素化ルビジウム(RbH)
- ストロンチウム:水素化ストロンチウム(SrH2)
性質
典型元素の水素化合物
典型元素の水素化物は、周期表の族に特有の性質を示す(詳細は下に示す各元素族水素化物の項に詳しい)。
- 第1族元素水素化物の性質 - 1H, 3Li, 11Na, 19K, 37Rb, 55Cs, 87Fr
- 第2族元素水素化物の性質 - 4Be, 12Mg, 20Ca, 38Sr, 56Ba, 88Ra
- 第13族元素水素化物の性質 - 5B, 13Al, 31Ga, 49In, 81Tl
- 第14族元素水素化物の性質 - 6C, 14Si, 32Ge, 50Sn, 82Pb
- 第15族元素水素化物の性質 - 7N, 15P, 33As, 51Sb, 83Bi
- 第16族元素水素化物の性質 - 8O, 16S, 34Se, 52Te, 84Po
- 第17族元素水素化物の性質 - 9F, 17Cl, 35Br, 53I, 85At
金属の水素化合物
金属との水素化合物では、水素の酸化数が −1 となっている。これらは金属陽イオンと水素化物イオン H− のイオン性化合物、水素化物である。金属の水素化物は水と容易に反応して水素を発生する。
- MHn n H2O → M(OH)n n H2
おもに有機化合物への還元剤、特に水素化試薬として用いる。
非金属の水素化合物
非金属との水素化合物では、水素の酸化数は 1 である。これらは水素化物イオンを持たないため、水素化物とは呼ばない。17族元素との水素化合物はハロゲン化水素と呼ばれ、フッ化水素が弱酸である他は全て強酸である。
また、炭素との水素化合物は炭化水素であり石油中に多くの種類が産出する。
エネルギー源としての水素化物
20世紀に入り石炭から石油へとエネルギー構造転換が起こった結果、水素化物である炭化水素が人類のエネルギー消費の大半を担うようになった。化石燃料である石油資源の枯渇は当初より問題視されていたが、21世紀の今日においても、炭化水素がエネルギーシステムにおける役割には依然として非常に大きいものがある。実際1940年代以降より炭化水素の代替となるエネルギーシステムが種々研究開発されてきたがいまだ決定的なものは見出されていない。
電力などエネルギーシステムの一部では原子力、太陽光、風力などの代替エネルギーの利用が進んではいるが、輸送など広く利用され経済性とポータビリティの両立が必要なエネルギーシステムにおいては、炭化水素の代替となるエネルギーシステムはいまだ見出されていない。
一部では、次世代のエネルギーシステムとして水素が脚光を浴びている。水素であれば熱機関のエネルギー源としても利用可能であるし、燃料電池の様に電力を発生させることも可能である。また、原子力、太陽光、風力のような巨大な発生装置と固定化されたエネルギー配給システムに依存しなくても良いという長所を持つため、水素エネルギーシステムは経済性やポータビリティーの面で次世代のエネルギーシステムの有力候補と考えられている。
しかしながら、現在の技術においてはポータビリティの面で水素は炭化水素を凌ぐものとはみなされていない。ポータビリティを満足するには、体積エネルギー密度、重量エネルギー密度の両方を満たす必要がある。水素の重量エネルギー密度こそガソリンの三倍程度であるが、体積エネルギー密度では炭化水素に及ばないため、貯蔵に大きな体積を必要とする。現在の技術レベルで最もエネルギー密度が大きくなる液体水素であっても、メタンガスや石油などの炭化水素のエネルギー密度に比べて4分の1程度でしかない。固体水素も存在するが、必要な温度は極端に低く、圧力は極端に高過ぎる為、現在の技術では製造も保管も困難である。
したがって、現在考えられている経済的に引き合う水素エネルギーシステムは、水素をエネルギー媒体とするのではなく、メタンから合成されるメタノールなど炭化水素を基盤として利用することが検討されている。しかしそのようなエネルギーシステムでは炭化水素エネルギーシステムと同義であることから、金属水素化物など水素源となりうる新規の水素化物が検討されている。
脚注
関連項目
- 水素#ヒドリド
- 酸化物
- DHMO
- 水素吸蔵合金
外部リンク
- Table 2 Mononuclear hydrides